باتری
- 5 دقیقه زمان مطالعه
- بدون نظر
باتری از اصلی ترین بخش ها در مدارهای الکتریکی و الکترونیکی است که به عنوان منبع انرژی عمل میکند. باتریها انرژی شیمیایی را با کمک تغییرات شیمیایی به انرژی الکتریکی تبدیل می کنند.
باتری یک دستگاه الکتروشیمیایی است که از یک یا چند بخش کوچکتر ساخته شده به نام سلول که انرژی شیمیایی را به انرژی الکتریکی تبدیل میکند. هر سلول باتری دارای دو الکترود (کاتد و آند) و یک الکترولیت است.واکنش های شیمیایی درون این دو بخش باعث تبدیل انرژی مذکور میشود.
بیشتر بدانیم:
آند:
الکترودی است که در الکترونها آزاد میشوند. آند معمولاً به قطب منفی باتری متصل است.
کاتد:
الکترودی است که الکترونها به آن وارد میشوند. کاتد معمولاً به قطب مثبت باتری متصل است.
الکترولیت:
ماده ای میان اند و کاتد که جا به جایی بار را ممکن می کند.
باتریها بر اساس ویژگیهای مختلفی دستهبندی میشوند. از جمله مهمترین انواع باتریها میتوان به موارد زیر اشاره کرد:
باتری های یکبار مصرف
این باتریها پس از یک بار استفاده تخلیه شده و قابل شارژ نیستند. این باتریها برای وسایلی که نیاز به مصرف طولانی مدت بدون نیاز به شارژ دارند، مناسب هستند. از جمله مثالهای در دسترس در کنترلهای تلویزیون و ساعتها استفاده میشوند.
باتری های شارژ شو یا چند بار مصرف
این نوع باتریها پس از تخلیه میتوانند مجدداً شارژ شده و دوباره مورد استفاده قرار گیرند. باتریهای قابل شارژ معمولاً در وسایلی که به منبع انرژی قابل شارژ نیاز دارند، مانند تلفنهای همراه، لپتاپها و اتومبیلهای الکتریکی استفاده میشوند.
یکی از مثال های معروف انها باتریهای لیتیوم-یون اند که یکی از محبوبترین انواع باتریهای قابل شارژ هستند که به دلیل چگالی انرژی بالا، وزن کم و عمر طولانی در بسیاری از دستگاههای مدرن مانند گوشیهای هوشمند، لپتاپها و خودروهای برقی استفاده میشوند.
همچنین میتوان باتری هارا از نظر ظاهری هم تقسیم بندی کرد:

اما در مدار های الکتریکی باتریها به عنوان منابع تغذیه عمل میکنند. این منابع تغذیه انرژی الکتریکی را فراهم کرده و جریان الکتریکی مورد نیاز برای عملکرد اجزای مختلف مدار را تأمین میکنند. بسته به نوع مدار و دستگاه، باتریهای مختلفی مورد استفاده قرار میگیرند.
درمدار های کوچک و جمع و جور باتریها در مدارهای الکتریکی کوچک مانند مدارهای ساعتها، ریموتها و وسایل خانگی به عنوان منبع اصلی تغذیه عمل میکنند. در این مدارها از باتریهای کوچک با ولتاژ پایین استفاده میشود.
در دستگاههای بزرگتر و پیچیدهتر مانند گوشیهای هوشمند، لپتاپها و تجهیزات پزشکی، باتریها باید انرژی بیشتری فراهم کنند. در این موارد، از باتری هایی استفاده میشود که قابلیت ذخیره انرژی بیشتری دارند و بهطور مکرر شارژ میشوند.
از کاربرد هایی که کمتر به ان توجه میشود میتوان به بودن منبع تغدیه پشتیبان در برخی دستگاهها و سیستمها، اشاره کرد به عنوان مثال، در سیستمهای UPS (منابع تغذیه بدون وقفه)، باتریها در زمان قطع برق وارد عمل شده و دستگاههای حساس را تغذیه میکنند.
با توجه به متفاوت بودن باتری ها در کارکردشان میتوان به این نتیجه رسید که انتخاب باتری درست بسیار مهم است.
پارامترهای مهم در انتخاب باتری مناسب
در انتخاب یک باتری برای استفاده در مدار، چند پارامتر کلیدی باید در نظر گرفته شود:
ولتاژ:
ولتاژ یک باتری نشاندهنده اختلاف پتانسیل بین دو قطب آن است. ولتاژ باید با نیاز مدار همخوانی داشته باشد.
ظرفیت باتری:
ظرفیت باتری به میزان انرژی الکتریکی ذخیره شده در باتری اشاره دارد و بر حسب میلیآمپر ساعت (mAh) یا آمپر ساعت (Ah) اندازهگیری میشود. ظرفیت بیشتر به معنی توانایی بیشتر باتری برای تامین انرژی برای مدت زمان طولانیتر است.
تعداد شارژ و دشارژ:
در باتریهای قابل شارژ، تعداد دفعاتی که باتری میتواند شارژ و تخلیه شود بدون کاهش قابل توجه در عملکرد، مهم است.
وزن و سایز:
البته باید توجه داشت اندازه و سایز وسیله یا مدار روی اندازه باتری هم تاثیر دارد پس وزن و سایز اصولا اولین پارامتر مورد بررسی است.

مزایا و معایب استفاده از باتری ها
مزایا:
بزرگترین علتی که ما را به استفاده انبوه باتری ناچار میکند کارکردن آن بدون نیاز به برق شهری و قابل حمل بودن آن در سایز مناسب است.
معایب:
باتریهای اولیه غیرقابل شارژ هستند و پس از مصرف دور ریخته میشوند به این معنا که قابل شارژ ها هم بعد مدتی از کار میفتند و دور انداخته میشوند، که میتواند برای محیط زیست مضر باشند.
برخی باتریها حساس به دما هستند و ممکن است در دماهای بالا دچار مشکلات ایمنی شوند.
به طور ساده میتوان باتری را سلول یا یک پک شیمیایی (chemical power pack) تعریف کرد که در مواقع نیاز، میتواند انرژی شیمیایی را به به انرژی الکتریکی تبدیل کند. یک باتری با انجام واکنشهایی شیمیایی درون خود، انرژی شیمیایی موجود را به انرژی الکتریکی تبدیل میکند. باتری بسته به مشخصات ساختاری و نوع استفاده از آن، میتواند عمری بین چند ساعت تا چند هفته داشته باشد.
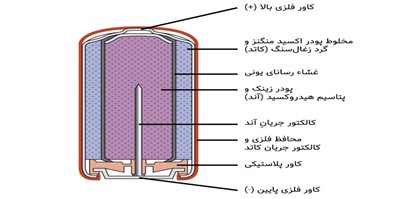
ساختار باتری
قسمت اصلی یک باتری که انرژی الکتریکی لازم را فراهم میکند، سلول (Cell) نام دارد. سلول باتری از ۳ جزء (دو الکترود و یک ماده شیمیایی به نام الکترولیت) تشکیل شده است
جهت ایزوله کردن سلول از محیط بیرون و همچنین فراهم کردن ایمنی و راحتی استفاده، سلول درون یک بسته یا کِیس (case) خارجی (فلز یا پلاستیکی) قرار دارد. در این بسته خارجی دو الکترود با علامتهای + (قطب مثبت) و – (قطب منفی) وجود دارد که به دو الکترود داخلی سلول متصل هستند.
هنگامی که دو الکترود باتری به یک مدار، به طور مثال یک لامپ ساده، متصل شوند، ماده شیمیایی درون سلول (الکترولیت) شروع به فعالیت میکند. در واقع این مواد طی واکنشهایی شیمیایی به آرامی به مواد دیگری تبدیل میشوند. میتوان گفت که طی واکنشهای شیمیایی خاصی که در الکترولیت اتفاق میافتد، یونهایی تشکیل و الکترونهایی آزاد میشوند.
الکترونهای آزاد شده میتوانند از سر قطب منفی در مدار شارش کرده و انرژی الکتریکی مورد نیاز مدار را تامین کنند. این روند تا زمانی که ماده الکترولیت به طور کامل دگرگون شود (به ماده دیگری تبدیل شود) ادامه پیدا میکند. در این صورت، حرکت یونها در الکترولیت و شارش الکترونها در مدار متوقف میشود.
الکترونهای جریان یافته در مدار، به قطب یا الکترود مثبت وارد شده و از این طریق میتوانند جذب یونهای مثبت موجود در الکترولیت شوند. بدین ترتیب الکترون و یونها توسط واکنشهای شیمیایی که در الکترولیت رخ میدهد در جریان هستند. اینکه واکنش شیمیایی به چه شکل است، بستگی به جنس ماده الکترولیت و الکترودهای فلزی دارد. در بخش بعدی، به هنگام معرفی انواع باتری، به چندین ماده الکترولیت اشاره میکنیم. پرداختن به واکنشهای شیمیایی در اینجا خارج از هدف این مقاله است. اما به هر حال میتوان گفت که مکانیزم عملکرد تمامی باتریها به شرح فوق است.
از آنجایی که در ماده الکترولیت واکنشهای شیمیایی پیدرپی رخ میدهند، در نهایت تمامی ماده الکترولیت اولیه به ماده دیگری تبدیل شده و دیگر توانایی انجام تشکیل یونهای مورد نیاز را ندارد. بدین ترتیب به مرور زمان، ولتاژ باتری افت پیدا میکند. از آنجایی که ولتاژ یا به بیان دیگر اختلاف پتانسیل عامل حرکت بار الکتریکی است، با کاهش ولتاژ باتری، الکترونهای مورد نیاز جهت تامین انرژی ادوات الکتریکی در مدار شارش پیدا نمیکنند.
ممکن است برایتان سوال پیش آید که چرا الکترونها برای رفتن به قطب مثبت، مسیر کوتاهتر یعنی از طریق الکترولیت را انتخاب نمیکنند؟! برای پاسخ به این سوال نیازی به بررسی شیمیایی ساختار الکترولیت نیست. در واقع الکترولیت از نظر الکتریکی همانند عایقها بوده و مقاومت آن بالاست، در نتیجه همانند سدی در برابر عبور الکترونها عمل کرده و الکترونها به ناچار از مسیر بیرونی (سیم رسانا) جریان مییابند.
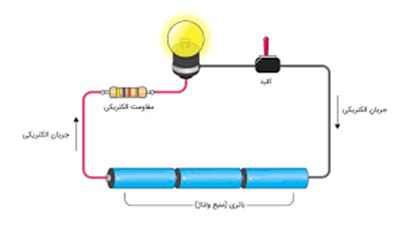
همانطور که متوجه شدید، جریان الکتریکی که در واقع همان شارش الکترونها است، از قطب منفی باتری بوده و به سمت قطب مثبت میرود. اما در فیزیک الکتریسیته و مهندسی برق، جهت جریان را به صورت قراردادی از قطب مثبت به قطب منفی در نظر میگیرند.
